Пищевая сода, или, как её называют иначе, столовая, питьевая, чайная, знакома, пожалуй, всем: её используют для придания тесту пышности и рыхлости, для очищения посуды и кафеля, для уничтожения вредителей в саду и огороде, для устранения огрубевшей кожи со стоп и отбеливания зубов — перечислять можно долго, однако при всём этом мало кто задумывается о химических свойствах порошка или о том, какая формула у соды. И совершенно зря, поскольку знание природы вещества и сведений относительно его физических и химических качеств зачастую позволяет расширить кругозор относительно возможностей и сфер его использования.
К тому же, далеко не всем известно, что сода имеет несколько разновидностей, которые отличаются друг от друга не только по своим характеристикам, но и по степени безопасности для здоровья человека. Вот как раз об этом мы и поговорим.
Определение и формула соды
В понятие «сода» химики включают все натриевые соли угольной кислоты, и таковых, в зависимости от химического соединения, всего 3.
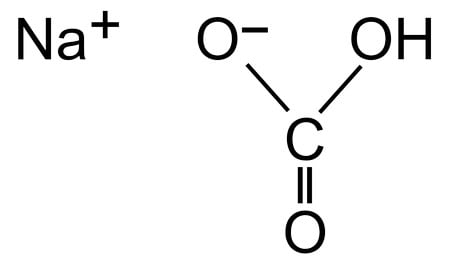
- Пищевая (чайная, питьевая, столовая) — наиболее распространённый вариант, с химической точки зрения именуемый как бикарбонат натрия, гидрокарбонат натрия, натрий двууглекислый или пищевая добавка Е500. Вещество представляет собой мелкокристаллический порошок, который характеризуется белым цветом, слабовыраженным запахом и наличием солёно-горького вкуса. В науке пищевая сода обозначается записью NaHCO₃
- Кальцинированная сода (техническая, стиральная) — вещество, получившее своё второе название по причине его использования в качестве средства для стирки белья и одежды. Карбонат натрия (так именуют его химики) внешне очень подобен пищевой соде, однако путать два этих вещества не стоит: кальцинированная сода является щёлочью сильного действия, которая при неправильном и неосторожном обращении может вызывать раздражения и ожоги слизистых и кожных покровов. Химическая формула карбоната натрия выглядит следующим образом: Na₂СО₃
- Каустическая сода (каустик) — известна как едкая щёлочь, едкий натр, имеет и другое название — гидрокссид натрия. Вещество обладает сильно выраженными щелочными характеристиками, имеет вид твёрдых гранул белого цвета, у которых отсутствует какой-либо запах. Несмотря на то, что едкий натр зарекомендовал себя как эффективное чистящее средство, использовать его следует осторожно: высокая концентрация гидроксида натрия разъедает соединения органического происхождения и вызывает ожоги кожи. В области химии каустическая сода обозначается формулой NaOH
Таким образом, принципиальная разница между тремя названными разновидностями заключается в степени щелочной реакции, которую они способны создавать, и, соответственно, в сферах деятельности человека, где они могут использоваться.
Пищевая сода
Пожалуй, в каждом доме есть картонная коробочка, дизайн которой не меняется вот уже много лет. В ней содержится белый мелкокристаллический порошок, практически не обладающий запахом, но отличающийся немного горьковатым вкусом, — речь идёт о пищевой соде, которая используется людьми в различных целях и становится настоящим помощником по удалению загрязнений, уничтожению вредителей, лечению различных заболеваний.
Первая сода, полученная искусственным путём, появилась лишь в XVIII веке, благодаря опытам французского учёного Анри Дюамеля де Монсо, который с этой целью использовал метод кристаллизации. Промышленным способом содовый порошок стали производить сначала в России: этому послужило открытие химика Э. Лаксмана, выяснившего, что при спекании древесного угля и смеси сульфата натрия можно получить натрий двууглекислый. Однако широкого распространения данная методика всё же не получила, и со временем, начиная с 1791 года, содовый порошок стали производить посредством сплавления древесного угля, смеси сульфата натрия и мела. Такая технология была открыта французским учёным Н. Лебманом. С 1838-1840-х г был предложен аммиачный метод, который отличался не только экономичностью, но и возможностью получать соду более высокого качества. С тех пор и до настоящего времени натрий двууглекислый получают именно этим способом.
Гидрокарбонат натрия характеризуется рядом определённых химических свойств: при нагревании до 60 С он начинает плавится, в результате чего распадается на карбонат натрия, углекислый газ и воду. Именно таким образом из натрия двууглекислого получают другую разновидность — кальцинированную соду. Вещество не растворяется в ацетоне и спирте, однако довольно хорошо растворяется в тёплой или горячей воде. При взаимодействии с ней образуется раствор, обладающий слабощелочной средой, в связи с чем соду, которая по своей сути является натриевой солью угольной кислоты, нередко называют щёлочью. рН воды, в которой растворяется бикарбонат натрия, равен 8-9, что и указывает на не агрессивность получаемого содержимого. Нередко такое вещество используют в качестве лечебного средства, при помощи которого понижают повышенную кислотность и борются с изжогой, грибковыми заболеваниями, неприятным запахом изо рта.
Химическая реакция также происходит в результате соединения натрия двууглекислого с кислотами и, в частности, с уксусом. При взаимодействии этих двух компонентов пищевая сода начинает выделять углекислый газ и воду, вследствие чего можно наблюдать специфическое «шипение». Именно такую реакцию мы получаем на кухне при замешивании теста: высвобождение углекислого газа в результате взаимодействия натрия двууглекислого и уксуса способствует «росту» пирога и приданию ему рыхлости и воздушности.
Интересное видео: Химическая реакция уксуса с содой красиво
Однако применяется содовый порошок не только в сфере кулинарии: зачастую он «спасает» тогда, когда под рукой не оказывается чистящих средств, но есть загрязнения, которые нужно срочно устранить. При помощи соды можно избавиться от многих пятен на поверхности стола или холодильника, вымыть посуду и кафель. За счёт безопасности для здоровья, пищевую соду можно применять в качестве очищающего средства для мытья именно детской посуды, ведь ни одна промышленная жидкость не может похвастаться таким важным критерием. Называть качества гидрокарбоната натрия, которые могут быть полезными для человека, можно довольно долго, но об этом мы поговорим несколько позже.
Кальцинированная, или бельевая, техническая сода
Ещё одна разновидность соды — карбонат натрия, или кристаллическая, бельевая, стиральная сода. Своё второе название она получила в соответствии с той сферой, в которой применяется: вещество отлично устраняет различные загрязнения, в виду чего его иногда используют вместо стирального порошка.
Формула кальцинированной соды выражается записью Na2CO3. Вещество выпускают в двух формах: в виде крупных кристаллов (тип А) и в виде порошка (тип В). В зависимости от критерия принадлежности к одной из марок, карбонат натрия применяется в различных областях.
Кальцинированная сода характеризуется белым цветом и отсутствием запаха, она хорошо растворяется в воде и довольно легко впитывает запахи и влагу, превращаясь при этом в твёрдое вещество. Карбонат натрия является сильной щёлочью (рН 11), поэтому обращаться с ним нужно крайне осторожно.
В промышленности кальцинированную соду получают несколькими методами:
- из нефелинового сырья;
- из соды, добываемой в природе;
- аммиачно-хлоридным способом;
- посредством карбонизации каустической соды.
Интересное видео: Технологии производства соды
Естественным путём соду добывают из золы морских водорослей, некоторых озёр, а также в подземных солях в виде минералов термонатрита, натрона, трона, нахколита. Странами, богатыми данным веществом, являются США, Россия, Канада, Мексика, ЮАР, Кения. Из пластиковых металлов соду получают посредством прокаливания, а из озёр — при помощи кристаллизации.
Самый распространённый метод получения соды — аммиачно-хлоридный. Данная технология изготовления позволяет производить вещество высокого качества, но при минимуме затрат. В условиях низких температур раствор хлористого натрия подвергается насыщению двуокисью углеводорода и аммиаком. Вследствие этого процесса выпадает осадок натрия двууглекислого, который проходит фильтрацию и дальнейшее кальцинирование. Именно так и получается кальцинированная сода.
Каустическая сода
Наиболее сильной щёлочью из всех разновидностей соды выступает едкий натр, или, иначе говоря, каустик, каустическая сода. В области химии данное вещество носит название гидроксид натрия и имеет формулу NaOH. При высоких концентрациях каустическая сода способна разъедать соединения органического происхождения, вызывать ожоги и сильные раздражения, она обладает и рядом других опасных свойств, в связи с чем её транспортируют исключительно в водонепроницаемых мешках.
Внешне гидроксид натрия представляет собой твёрдое вещество белого цвета, у которого отсутствует какой-либо запах. Каустик прекрасно растворяется в спиртовых растворах и воде, но не взаимодействует с эфирами и ацетоном. Кроме того, едкий натр вступает в реакцию с оловом, цинком, свинцом, алюминием, а с аммиаком — воспламеняется. Каустическая сода не горит, однако кипит и плавится при температуре, составляющей не менее 390 С. Вещество обладает способностью к нейтрализации загрязнений и жиров, в связи с чем оправдано его применение в качестве очищающего средства.
В промышленности гидроксид натрия производят, начиная с середины XVIII века. Вплоть до ХХ столетия при изготовлении едкого натра применялась аммиачная и известковая технология получения. Впоследствии был открыт электрохимический метод, который является приоритетным до сегодняшнего дня. Ведущие позиции по производству каустической соды сейчас занимают такие страны, как США, Китай, а также многие европейские государства.
Общие химические свойства соды
Все три разновидности соды относятся к классу натриевых солей угольной кислоты. Они обладают щелочными характеристиками при взаимодействии с водой, но уровень рН при этом отличается, в связи с чем только пищевая сода может применяться в домашней кулинарии и народной медицине, поскольку именно гидрокарбонат натрия имеет самый низкий водородный показатель. За счёт того, что любой вид соды можно по праву назвать щёлочью, использовать каждое из веществ допускается с целью устранения жира и загрязнений: гидрокарбонат натрия, а также кристаллическая и каустическая сода прекрасно справляются с данной задачей.
Сходство химических свойств заключается не только в принадлежности к солям, имеющим щелочные качества, но и в способности достаточно хорошо растворяться в воде. Кроме того, и пищевая, и кальцинированная сода не взаимодействуют со спиртовыми растворами, то есть не могут растворяться в них, чем одновременно отличаются от едкого натра.
От степени агрессивности веществ зависит место их применения: если гидрокарбонат натрия активно используется в быту, кулинарии и при лечении различных заболеваний, то сфера, в которой просто необходимо участие карбоната и гидроксида натрия, — это промышленность.
Контактировать с кальцинированной содой и особенно каустиком следует очень осторожно: оба вещества, за счёт высокого уровня рН, являются сильными раздражителями, которые могут спровоцировать ожоги слизистой и кожных покровов и даже вызвать интоксикацию организма.
Применение
Самым распространённым вариантом в домашнем обиходе является гидрокарбонат натрия. Чаще всего его используют в кондитерском деле, поскольку при взаимодействии пищевой соды и уксуса происходит выделение углекислого газа, придающего выпечке пышную и рыхлую структуру. К слову сказать, именно натрий двууглекислый выступает основным компонентом привычного всем разрыхлителя, который в кулинарии зачастую применяется вместо самой пищевой соды. Однако только этим важность компонента на кухне не ограничивается. Некоторые хозяйки идут на уловку и добавляют данное вещество в омлет, за счёт чего он получается не только вкусным, но и воздушным. Другие применяют содовый порошок для размягчения слишком жёсткого мяса или ускорения процесса приготовления гороха, фасоли. При помощи пищевой соды допускается промывание фруктов и овощей: это позволяет уничтожить нитраты, а заодно — продлить срок их хранения. Если добавить небольшое количество соды в кастрюлю, можно предотвратить прилипание круп к её дну или свёртывание молока в процессе его кипячения.
Видео — 20 НЕОБЫЧНЫХ ПРИМЕНЕНИЙ СОДЫ | ЛАЙФХАКИ С СОДОЙ
Ещё одно, несомненно, важное достоинство гидрокарбоната натрия — наличие у данного вещества целого спектра лечебных свойств: противогрибкового, антисептического, антибактериального, дезинфицирующего, смягчающего. Чаще всего пищевую соду используют для нейтрализации повышенной кислотности в организме и последующего восстановления водного баланса.
Натрий двууглекислый становится настоящим помощником при:
- боли в горле во время простудных заболеваний;
- изжоге;
- ожогах, раздражениях, вызванных укусами насекомых;
- молочнице, грибковых поражениях стоп;
- отбеливании зубной эмали;
- инфекционных заболеваниях полости рта;
- интоксикации, в том числе и алкогольной;
- обезвоживании организма;
- остеохондрозе, болях в суставах, подагре;
- аритмии и повышенном АД;
- морской болезни;
- фурункулах, натоптышах, мозолях;
- гипергидрозе;
- похудении;
- онкологических заболеваниях (согласно одной из теорий).
В быту актуальным становится абсолютно любой вид соды, однако контактировать с карбонатом или гидроксидом натрия следует очень осторожно, в связи с чем перед началом работы рекомендуется надевать резиновые перчатки. Средства достаточно эффективно справляются с различными загрязнениями, однако для удаления давнишних пятен рекомендуется использовать кальцинированную соду, которая также подойдёт для освежения деталей стиральной машины и уничтожения с них накипи.
При помощи пищевой соды можно до блеска вычистить раковину, столешницу, сантехнику, ковры, посуду, при этом необходимо помнить, что изделия из алюминия отмывать с применением даже неагрессивного гидрокарбоната натрия нельзя, так как они покрыты специальной оксидной плёнкой, предохраняющей металл от окисления и проникновения в пищу вредных компонентов. Однако пищевая сода станет находкой для очищения других деликатных поверхностей: линолеума, мрамора, кафеля. Её использование актуально в том случае, если нужно избавиться от неприятного запаха, например, в холодильнике. А вот для отбеливания белья и устранения пятен с одежды чаще всего применяют кальцинированную соду, поскольку именно карбонат натрия с подобной задачей справляется гораздо лучше.
В промышленности широкой популярностью пользуется каустическая сода. Она принимает участие в следующих отраслях:
- целлюлозно-бумажная: производство искусственных волокон, картона и бумаги;
- строительство: укрепление фундаментов, изготовление газобетона;
- текстиль: отбеливание тканей и регенерация резины;
- химическая промышленность: очищение нефтепродуктов, производство масляной продукции;
- военная отрасль: применение в противогазе с целью устранения углекислого газа из воздуха, нейтрализация опасных газов.
Также каустическая сода используется практически на каждом предприятии, поскольку выполняет роль средства, очищающего промышленное оборудование и инвентарь от жира и загрязнений. Вместе с тем, едкий натр нередко выступает компонентом, входящим в состав стиральных порошков, мыла, косметической продукции.
Техника безопасности
Гидрокарбонат натрия при взаимодействии с водой в небольших концентрациях является нетоксичным для здоровья человека веществом. Однако это совершенно не говорит о том, что содовый порошок безопасен. По степени пожаро — и взрывоопасности он относится к 3-му классу. Отдельно следует рассматривать ограничения присутствия натрия двууглекислого в воздухе: 5 мг на куб.метр. Хранить вещество необходимо в недоступном для детей и животных месте.
Работая с карбонатом натрия, в целях предотвращения ожогов кожных покровов, необходимо надевать резиновые перчатки, что же касается каустической соды, то для контактирования с ней одних перчаток, как правило, недостаточно: кроме них, применяется маска, халат, а также специальные очки.
Соду можно по праву назвать универсальным средством, которое имеет довольно широкую популярность, за счёт своего применения в различных сферах деятельности. Однако одновременно с этим не стоит умалять её способность оказывать негативное воздействие на организм человека, в связи с чем рекомендуется помнить о мерах предосторожности, а также чётко соблюдать правильные пропорции при выполнении лечебных и бытовых растворов.






